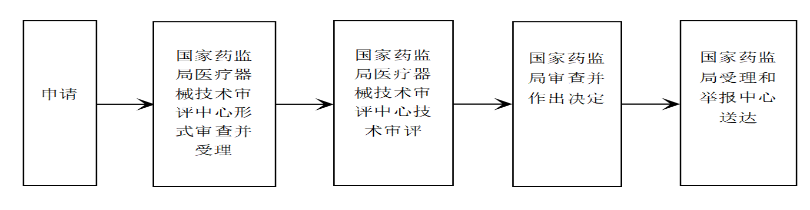
湖南医药集团大医工科技有限公司是湖南医药发展投资集团下属战略型三级子公司,公司定位为医疗器械全生命周期服务平台。大医工依托国有资本与产业资源优势,已形成医疗器械CDMO(研发/转化/制造)、CRO(全球注册及临床服务)、产品生产制造(小试一中试一量产一市场推广)三大核心业务体系,可为医疗器械产业链提供专业化的研发、注册、转化、生产和销售全流程服务。

办理条件
申请人应为境内依法进行登记的企业
申请材料清单
1.申请表
2.明性文件
(1)注册人企业营业执照的副本和组织机构代码证复印件。
3.关于产品没有变化的声明
(1)注册人提供产品没有变化的声明。
4.原医疗器械注册证及其附件复印件、历次医疗器械注册变更文件复印件
5.注册证有效期内产品分析报告
(1)产品临床应用情况,用户投诉情况及采取的措施。
(2)医疗器械不良事件汇总分析评价报告,报告应对医疗器械上市后发生的可疑不良事件列表、说明在每一种情况下生产企业采取的处理和解决方案。对上述不良事件进行分析评价,阐明不良事件发生的原因并对其安全性、有效性的影响予以说明。
(3)在所有上市国家和地区的产品市场情况说明。
(4)产品监督抽验情况(如有)。
(5)如上市后发生了召回,应当说明召回原因、过程和处理结果。
(6)原医疗器械注册证中载明要求继续完成工作的,应当提供相关总结报告,并附相应资料。
6.产品检验报告
(1)如医疗器械强制性标准已经修订,应提供产品能够达到新要求的产品检验报告。产品检验报告可以是自检报告、委托检验报告或符合强制性标准实施通知规定的检验报告。其中,委托检验报告应由具有医疗器械检验资质的医疗器械检验机构出具。
(2)如有国家标准品、参考品发布或者更新的,应提供产品能够符合国家标准品、参考品要求的产品检验报告。产品检验报告可以是自检报告、委托检验报告或符合相应通知规定的检验报告。
7.符合性声明
(1)注册人声明本产品符合《体外诊断试剂注册管理办法》和相关法规的要求;声明本产品符合现行国家标准、行业标准,并提供符合标准的清单。
(2)所提交资料真实性的自我保证声明。
8.其他
如在原注册证有效期内发生了涉及产品说明书和/或产品技术要求变更的,应当提交依据注册变更文件修改的产品说明书和/或产品技术要求各一式两份。